Després de veure la química alimentària dels carbohidrats i els lípids, no podia deixar incomplet el trio sense portar també les de les proteïnes, aquest macronutrient que és la nineta dels ulls dels qui realitzem entrenament de força 😉
De la mateixa manera que en les altres dues ocasions, aquesta entrada complementa la de bioquímica de les proteïnes del trimestre passat, tot i que no sabria dir exactament quin seria l’ordre de lectura més adequat. Sigui com sigui, no deixeu de donar-li una ullada.
Lectura prèvia recomanada:
Introducció
La importància de les proteïnes en els sistemes biològics és indiscutible. Al voltant de 3.000 proteïnes diferents realitzen en el cos dels éssers vius una infinitat d’activitats:
- Estructurals
- De transport
- De defensa
- Enzimàtiques
Totes deriven de la combinació de 20 aminoàcids, que a la vegada estan codificats en el codi genètic.
En l’aspecte nutricional no són pas menys importants, ja que els sers vius que les ingereixen són capaços de realitzar funcions plàstiques, energètiques (aporten 4 kcal per gram de pes) i de regulació, necessàries per a ells. De fet, la ingesta necessària d’aquestes proteïnes és coneguda i depèn de l’estat fisiològic en el que es trobi l’ésser, per exemple.
 Les principals fonts de proteïna de la natura les trobem en la carn, la llet, el peix i els ous i, en menor mesura, en els cereals i llegums.
Les principals fonts de proteïna de la natura les trobem en la carn, la llet, el peix i els ous i, en menor mesura, en els cereals i llegums.
Qualsevol proteïna és susceptible de ser utilitzada com a font alimentària però, en general, s’entén per proteïna alimentària totes aquelles que són fàcilment digeribles, no tòxiques, suficientment abundants, adequades i útils nutricional i funcionalment parlant.
(N. del T. I d’aquest últim paràgraf sorgeix un gran debat en el món de la nutrició sobre quines són les proteïnes que tenen aquestes propietats desitjades, que es torna més complicat quan ho hem de conciliar amb els aliments que en porten d’altres que fan que la balança es decanti cap a un costat o cap a l’altre).
És necessari citar altres fonts menys convencionals però de gran importància per al futur com són les algues, els llevats i els bacteris.
Tecnològicament és possible, inclús, enriquir el valor proteic dels aliments, extraient, concentrant i refinant proteïnes d’una matèria prima, com és el cas de lleguminoses com la soja, o de l’ou, la llet i fins i tot vegetals com la patata i l’alfals.
Les proteïnes en l’alimentació humana són omnipresents, des d’un punt de vista del desenvolupament del ser, des del punt de vista organolèptic i des del punt de vista industrial.
Proteïnes en els aliments i els seus processos
Desnaturalització proteica
Si heu donat una ullada a l’entrada anterior de bioquímica de les proteïnes, tindreu present que la seva estructura o conformació és el resultat de múltiples interaccions tant intramoleculars com intermoleculars, on els aminoàcids s’uneixen en enllaços peptídics de manera lineal per a formar l’estructura primària, que posteriorment conforma estructures més complexes a partir de la rotació dels enllaços i que combina diferents oligopèptids amb diferents tipus de plegament que donen lloc a infinitat de proteïnes diferents amb propietats úniques.
La desnaturalització proteica és la pèrdua d’aquestes estructures ordenades, a excepció de la primària. En aquest procés es veuen afectades les forces que intervenen en l’estabilitat de les diferents estructures de la proteïna i la relació amb el solvent que les envolta.
Això es deu, o és possible, gracies a canvis que es produeixen en l’ambient que envolta la proteïna i que són de naturalesa diversa. Degut a aquesta pèrdua nativa d’estructura, en la majoria dels casos també es perd la funcionalitat de la proteïna. El procés pot ser reversible en retirar l’agent o les condicions desnaturalitzants.
La desnaturalització no significa “pèrdua” en tots els casos, ja que el procés produït per exemple durant la cocció dels aliments, augmenta la seva digestibilitat. Un altre exemple d’efecte positiu de la desnaturalització és la formació de gels produïts pel calor. Com a norma general, es produeix un augment de la insolubilitat de la proteïna en el medi en el que es trobi.
Per a l’estudi d’aquest fenomen, es recorre a mesurar característiques que es veuen afectades per l’estructura que posseeix la proteïna, tals com l’absorbància en ultravioleta, la viscositat, u altres propietats modificades pel procés. S’observa com per a la major part de proteïnes, en augmentar el valor de l’agent desnaturalitzant, la propietat varia molt poc fins a un punt llindar, on canvia bruscament.
Això significa que la desnaturalització és cooperativa i que quan unes quantes interaccions es trenquen i comença a desplegar-se la molècula és quan comença la cadena de reaccions que augmenta ràpidament el desplegament de tota la proteïna.
Si observem el següent gràfic podem veure representat aquest concepte, on D és l’estat inicial de la proteïna i N és l’estat final (desnaturalitzada). Veiem que els principals factors en el procés són el canvi de temperatura (ΔGo) o un agent desnaturalitzant com la urea. Més info a l’enllaç següent.
Entrem una mica més en detall sobre quins tipus d’agent poden desnaturalitzar les proteïnes i com són.
Temperatura
 La temperatura és sense dubte l’agent desnaturalitzant de proteïnes més emprat des de l’antiguitat, amb la finalitat primordial d’augmentar la digestibilitat dels productes majoritàriament proteics. La influència de la temperatura en les forces que mantenen l’estructura és diferent segons aquestes forces. Els enllaços d’hidrogen, les interaccions electrostàtiques i de Van der Waals s’estabilitzen quan són exotèrmiques.
La temperatura és sense dubte l’agent desnaturalitzant de proteïnes més emprat des de l’antiguitat, amb la finalitat primordial d’augmentar la digestibilitat dels productes majoritàriament proteics. La influència de la temperatura en les forces que mantenen l’estructura és diferent segons aquestes forces. Els enllaços d’hidrogen, les interaccions electrostàtiques i de Van der Waals s’estabilitzen quan són exotèrmiques.
En realitat, els ponts d’hidrogen no es veuen afectats en estar situats per dins la molècula. Malgrat això, les interaccions hidrofòbiques s’estabilitzen en augmentar la temperatura, degut a la seva naturalesa endotèrmica. Els dos tipus de forces es contraposen fins a cert punt. En aquest punt és en el que es trenca la molècula d’aigua i, per tant, les forces hidrofòbiques no poden seguir augmentant al pujar la temperatura.
La major part de proteïnes tenen una temperatura de desnaturalització (que es defineix com la Tº a la que la meitat de les seves molècules es troben desnaturalitzades) al voltant dels 60 a 70ºC. A la temperatura a la que es comença a produir el procés se l’anomena temperatura de fusió, i és al voltant dels 40ºC.
 La temperatura també afecta a l’energia de conformació de les cadenes que les formen. Té a veure amb l’energia de Gibbs i l’organització de la matèria (conceptes d’entropia i entalpia) que ja varem tractar així per sobre en les passades entrades de bioquímica. L’augment de temperatura implica un decrement de l’energia lliure.
La temperatura també afecta a l’energia de conformació de les cadenes que les formen. Té a veure amb l’energia de Gibbs i l’organització de la matèria (conceptes d’entropia i entalpia) que ja varem tractar així per sobre en les passades entrades de bioquímica. L’augment de temperatura implica un decrement de l’energia lliure.
En el cas de baixes temperatures podríem suposar que pels motius anteriorment exposats les estructures proteiques tendirien a conservar-se molt millor, no obstant, això no és sempre així. Hi ha proteïnes, com la carboxipeptidasa A, que s’inactiva a temperatura de congelació, o la mioglobina, amb màxima estabilitat a 30ºC. En el cas de la desnaturalització per fred, existeixen altres causes com la formació de gel i la concentració de soluts al voltant, o simplement un trencament de teixits durant la congelació.
La desnaturalització per fred té aplicacions que trobem en la inactivació de certs enzims vegetals prèvia congelació dels aliments. En la indústria làctia, la comprobació de la inactivitat de la fosfatasa alcalina constitueix una prova de que el tractament tèrmic ha estat eficaç.
Com ja s’ha comentat, la desnaturalització pot ser reversible o irreversible, En molts casos en que la temperatura s’ha mantingut per sobre dels 100ºC durant un temps prolongat, es torna irreversible, no podent doncs tornar a la forma nativa de les proteïnes.
Donat que el comportament dels diferents aminoàcids varia segons la seva estructura, la composició de les proteïnes influirà molt en la seva estabilitat tèrmica. En general, les proteïnes amb major presència d’aminoàcids hidrofòbics solen ser més termostables.
A més a més, la presència d’aigua incideix en la desnaturalització tèrmica, de manera que les proteïnes deshidratades són molt més estables. La dessecació impedeix la mobilitat de les cadenes, mentre que la hidratació provoca un inflament que facilita la mobilitat i flexibilitat. La presència de certs soluts com la sal i els sucres pot augmentar la seva estabilitat tèrmica.
Pressió
 La desnaturalització per augment de la pressió hidrostàtica es produeix en el rang dels 1 a 12 kbar. Amb aquestes pressions la major part de les proteïnes pateixen un major empaquetament i una reducció del seu volum.
La desnaturalització per augment de la pressió hidrostàtica es produeix en el rang dels 1 a 12 kbar. Amb aquestes pressions la major part de les proteïnes pateixen un major empaquetament i una reducció del seu volum.
Les proteïnes fibril·lars són més estables als canvis de pressió que les proteïnes globulars, això és així degut a que el volum específic parcial de la proteïna en estat hidratat és major en aquestes últimes.
En qualsevol cas, el desplegament per augment de la pressió és parcial i reversible.
Notícia relacionada interessant
Batut i sacseig
 El batut o sacseig de les proteïnes també provoca a seva desnaturalització. La raó que explica aquest canvi és que la proteïna passa d’estar en una dissolució a estar incorporada en una interfase aire-líquid. En aquesta interfase les restes apolars s’orienten cap a la fase gas, mentre que els polars ho fan cap a la fase líquida.
El batut o sacseig de les proteïnes també provoca a seva desnaturalització. La raó que explica aquest canvi és que la proteïna passa d’estar en una dissolució a estar incorporada en una interfase aire-líquid. En aquesta interfase les restes apolars s’orienten cap a la fase gas, mentre que els polars ho fan cap a la fase líquida.
Les proteïnes més flexibles són més susceptibles a la desnaturalització en aplicar aquest tipus de forces.
Les forces provocades per un batut energètic, per exemple al batre la clara d’ou amb una batedora, provoca aquest canvi de les proteïnes al voltant de la seva hèlix, el que provoca de forma clara el canvi d’estat cap a l’espuma que observem durant el procés.
pH
 Les proteïnes són més estables quan es troben en el seu punt isoelèctric. A pH propers a la neutralitat les proteïnes estan carregades negativament però són relativament estables.
Les proteïnes són més estables quan es troben en el seu punt isoelèctric. A pH propers a la neutralitat les proteïnes estan carregades negativament però són relativament estables.
A pH extrems, sobretot bàsics o alcalins, tots els aminoàcids es troben carregats provocant fortes repulsions que aconsegueixen desdoblar els plegaments que formen les proteïnes, amb la conseqüent desnaturalització.
Tot i que en aquestes condicions el procés pot ser reversible, a pH alcalins extrems es produeixen certes ruptures d’enllaços peptídics o sulfhídrics que fan impossible la re-naturalització.
Solvents, soluts orgànics, detergents i sals caotròpiques
En general, els dissolvents orgànics modifiquen l’estabilitat de les interaccions hidrofòbiques, generant en petites quantitats més estabilitat, però provocant la desnaturalització a concentracions més elevades, degut a la solubilització de les parts apolars de les molècules, les seves cadenes laterals.
Els soluts orgànics tals com la urea, com hem vist abans, o el clorur de guanidina provoquen el desplegament de les proteïnes, trencant els ponts d’hidrogen molecular.
En el cas dels detergents, el SDS (dodecil sulfat de sodi) -que és un dels més emprats- per sobre de la concentració micel·lar crítica és capaç de desplegar la proteïna i establir micel·les al voltant dels restes hidrofòbics. En aquest cas la desnaturalització és irreversible, fins i tot a baixes concentracions de detergent.
Les sals són altament solubles i són molècules carregades, són electròlits forts en dissolució. Quan es troben en dissolució junt amb una proteïna, interaccionen electrostàticament amb els restes carregats dels aminoàcids i d’aquesta manera a baixes concentracions estabilitzen l’estructura. A majors concentracions l’estabilitat es veu influïda pel tipus de sals al igual que per la seva concentració.
Propietats funcionals
Les propietats funcionals són aquelles propietats tant físiques com químiques que es deriven del comportament de les proteïnes en els aliments, naturals o processats, durant la seva preparació i processat.
La següent taula resumeix les propietats que es relacionen amb els atributs sensorials dels aliments, com la textura, el sabor, el color i l’aspecte que mostren, i que determinen de manera clara l’acceptació per part del consumidor. Això inclou les interaccions d’aliments que conformen el sistema alimentari, on l’afegit de les proteïnes a d’altres aliments poden alterar aquestes característiques.
Val a dir que totes les propietats estan interrelacionades i és difícil determinar unitariament la participació de cadascuna en alguns processos complexos.
Propietats d’hidratació
 Aquest tipus de propietats es deriven de la interacció entre proteïna i l’aigua. En qualsevol aliment constitueix el component fonamental i les interaccions dipol-dipol entre l’aigua i la part del la proteïna com l’enllaç amida, els grups hidroxils i altres són constants.
Aquest tipus de propietats es deriven de la interacció entre proteïna i l’aigua. En qualsevol aliment constitueix el component fonamental i les interaccions dipol-dipol entre l’aigua i la part del la proteïna com l’enllaç amida, els grups hidroxils i altres són constants.
La capacitat per a lligar aigua es pot determinar experimentalment o empíricament a través d’una fórmula en la que es té en compte la composició en aminoàcids de la proteïna. A més, s’ha de tenir en compte que aquesta capacitat es veu condicionada per les condicions ambientals com la temperatura, el pH, etc.
La capacitat per a retenir l’aigua lligada és una característica molt important que permet una major acceptació de productes per part dels consumidors, com pot ser el cas de gels, productes de panaderia o la carn picada.
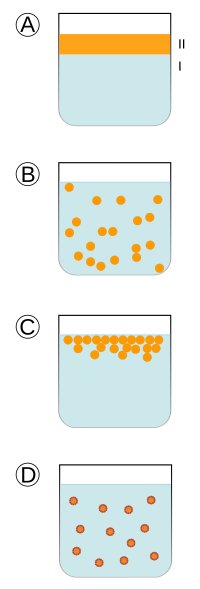
La solubilitat és la manifestació de l’equilibri existent entre les interaccions proteïna-proteïna i proteïna-solvent. Aquesta propietat afecta clarament les propietats funcionals tals com la gelificació, la emulsificat o l’escumat. En general, depen de la hidrofobicitat i la càrrega, a major càrrega i menor hidrofòbia, major solubilitat.
Atenent a aquestes propietats, podem classificar les proteïnes de la següent manera:
- Albúmines – Solubles en aigua a pH =6,6
- Globulines – Solubles en solucions salines diluïdes a pH = 7,0
- Glutelines – Solubles en solucions àcides (pH =2) i alcalines (pH = 12)
- Prolamines – Solubles en etanol al 70%
Propietats d’interfase
Existeixen molts processos alimentaris que consisteixen en dispersions, tipus líquid-líquid o líquid-gas, com per exemple les emulsions i escumes. En els aliments aplicats existeix una substància dispersa dins l’altra, per tant són dispersos i no pròpiament dissolucions.
Per aquest motiu són inestables, necessitant la col·laboració d’altres substàncies, com les proteïnes, que són anfifíliques i poden migrar fins la interfase, orientant les seves parts polars cap a una fase i les apolars cap a l’altre. Aquest procés facilita la dispersió, de tal manera que sense la seva col·laboració el procés no podria tenir lloc.
Durant la preparació, emmagatzemament i conservació de l’aliment, les proteïnes formen, a través d’aquestes capacitats tensioactives, una densa pel·lícula viscoelàstica que resisteix el xoc durant el procediment.
Les diferents proteïnes tenen capacitats interfacials molt diferents les unes de les altres, fonamentalment per la diferència entre la quantitat de restes hidròfobes e hidròfiles que posseeixen, i per d’altres característiques de la molècula com la flexibilitat de les cadenes i la distribució d’aquestes restes.
Veure Adsorció i aquest enllaç per a revisar una mica més aquests conceptes tant complicats.
Emulsió

 Les propietats emulsionants de les proteïnes les fan molt útils en aquest procés. Una emulsió o/w (oil/water o oli/aigua) està formada per una fase aquosa (dispersant) i una oliosa (dispersada), un emulgent o emulsionant i l’aportament d’energia necessari. Existeixen gran quantitat d’aliments en aquesta forma, com la llet, la maionesa, la mantega, aliments per a untar, gelats, etc.
Les propietats emulsionants de les proteïnes les fan molt útils en aquest procés. Una emulsió o/w (oil/water o oli/aigua) està formada per una fase aquosa (dispersant) i una oliosa (dispersada), un emulgent o emulsionant i l’aportament d’energia necessari. Existeixen gran quantitat d’aliments en aquesta forma, com la llet, la maionesa, la mantega, aliments per a untar, gelats, etc.
També existeixen emulsions w/o (al revés) però en aquest cas les proteïnes no son solubles a l’oli i, per tant, no poden estabilitzar-les.
Per a determinar les propietats emulgents d’una proteïna s’usen diversos mètodes:
- Índex d’activitat emulgent
- Carga proteica
- Capacitat emulgent
- Estabilitat de l’emulsió
Per a tots aquests mètodes existeixen tècniques de laboratori que les determinen, com són:
- Turbidimetria
- Microscòpia
- Contador Coulter
- Viscosimetria
- Cromatografia líquida d’alta eficàcia (HPLC)
Els factors principals que afecten la formació d’emulsions, són els que ja hem estat veient:
- Solubilitat
- pH
- Hidrofobicitat
Escumejat
 Pel que fa a les proteïnes escumejants podem dir que són molt necessàries per a aliments com la nata muntada, merenga, soufflès, pa, gelats, etc.
Pel que fa a les proteïnes escumejants podem dir que són molt necessàries per a aliments com la nata muntada, merenga, soufflès, pa, gelats, etc.
En aquests sistemes alimentaris hi trobem una fase líquida continua (dispersant) i una fase discontinua gasosa (fase dispersada), és a dir, bombolles d’aire que es troben disperses en una matriu líquida estabilitzada, en gran part, per la presència de proteïnes.
Hi ha dos paràmetres que ens indiquen la capacitat de formació d’escuma per part d’una proteïna:
- Poder escumejant
- Estabilitat de l’escuma
I de la mateixa manera que en les emulsions, hi ha diversos factors que modifiquen aquesta capacitat:
- pH
- Presencia de sals
- Presencia de sucres
- Presencia de lípids
- Concentració de la proteïna
- Temperatura
Retenció de sabors i aromes (flavors)
 Les proteïnes estan mancades d’olor, però si que son portadores de substàncies sàpides molt interessants des del punt de vista industrial (productes anàlegs de la carn fets amb proteïnes vegetals) i culinari. El tipus de proteïna i el processat de l’aliment influeixen notòriament en la fixació, retenció i alliberació del sabor.
Les proteïnes estan mancades d’olor, però si que son portadores de substàncies sàpides molt interessants des del punt de vista industrial (productes anàlegs de la carn fets amb proteïnes vegetals) i culinari. El tipus de proteïna i el processat de l’aliment influeixen notòriament en la fixació, retenció i alliberació del sabor.
Les interaccions entre els diferents flavors i les proteïnes solen ser de tipus no-covalent i depenen de l’humitat de l’aliment. Com en d’altres propietats, el pH, la presència de sals, la desnaturalització de la proteïna i d’altres factors diversos modifiquen la unió del flavor amb la proteïna.
Viscositat
 La resistència al flux d’una dissolució quan se li aplica una força és el que es coneix com a viscositat. Existeixen determinats aliments on aquesta propietat juga un paper decisiu per a l’acceptació del consumidor. El tipus de flux està íntimament relacionat amb el tipus de solut.
La resistència al flux d’una dissolució quan se li aplica una força és el que es coneix com a viscositat. Existeixen determinats aliments on aquesta propietat juga un paper decisiu per a l’acceptació del consumidor. El tipus de flux està íntimament relacionat amb el tipus de solut.
Val a dir que els sistemes alimentaris que contenen macromolècules no obeeixen al comportament Newtonià de fluids, ja que posseeixen comportaments pseudo-plasmàtics. En aquest tipus de sistemes, el coeficient de viscositat disminueix a mesura que augmenta la velocitat de deformació.
Quan el flux es detén la viscositat pot recuperar-se immediatament (dissolucions tixotropies) com és el cas de sistemes amb proteïnes tals com la de la soja o del sèrum lacti. Quan les proteïnes sónd e tipus fribrós com la gelatina o la miosina, poden o no recuperar la seva viscositat inicial, el coeficient del qual està íntimament relacionat amb la concentració i és exponencial.
Gelificació
 Aquesta propietat fa referència a la transformació que pateix la proteïna quan passa de l’estat sòlid a gel per diversos motius (calor, enzims, cations divalents, etc).
Aquesta propietat fa referència a la transformació que pateix la proteïna quan passa de l’estat sòlid a gel per diversos motius (calor, enzims, cations divalents, etc).
En realitat, un gel és un estat intermedi entre sòlid i líquid. En el procés es forma una xarxa tridimensional, gràcies a la interacció de forces de diversa naturalesa, que atrapen l’aigua i d’altres substàncies.
La formació del gel es du a terme en dues etapes successives:
- Primera etapa – Progel, formació de la solució altament viscosa a partir de la desnaturalització i polimerització
- Segona etapa – Formació de la xarxa tridimensional degut al refredament
En alguns casos, com en la gelatina, la formació de gel es pot revertir, mentre que en d’altres és un procés irreversible, com en el cas de la clara de l’ou.
Els dos tipus de gel que es poden formar són els opacs i els translúcids, la qual cosa depèn de la composició d’aminoàcids de la proteïna. Normalment els apolars donen lloc a reaccions que formen gels opacs.
En general els gels retenen una gran quantitat d’aigua (al voltant del 98%) i tot i que l’activitat de l’aigua és similar a la de l’aigua lliure, està mancada de mobilitat.
I per acabar…
Val a dir que la unitat és llarga. Fins aquí hem vist els processos i propietats de les proteïnes, però la unitat 2 continua amb els tipus de proteïna en funció del seu origen biològic, és a dir, proteïnes animals i vegetals, i explica les seves particularitats.
Donat que l’entrada s’està fent llarga i que hauria de passar ja a estudiar anatomia, de moment s’haurà de quedar aquí. Si hi ha temps i ganes, podeu esperar un Proteïnes (III).
Aquí va un vídeos que explica la bioquímica d’aquests conceptes de solubilitat, àcid-base i desnaturalització, crec que aquesta unitat se’l mereix 😉